生命現象は、様々な時空間スケールにおいて情報変換・情報伝達を伴います。当研究室では、生命現象に見られる情報変換・情報伝達の機構や過程を分
子、細胞を対象として研究しています。分子レベルでは、蛋白質のフォールディング機構と生物時計の概日リズム発振機構について研究しています。
また、細胞レベルでは、シナプス前神経末端の情報伝達機構とその可塑性のメカニズムについて研究しています。
分子レベルでの研究1−蛋白質のフォールディング機構の研究
蛋白質が、DNAの遺伝情報をもとにして、転写、翻訳を経て生合成されることはよく知られています。ところで、生合成されたポリペプチド鎖が生物学的
機能を発現するためには、これらポリペプチド鎖は特異的な天然立体構造を獲得しなければなりません。このように、ほどけたポリペプチド鎖が天然立体構造を
獲得する過程のことをフォールディングといいます(下図参照)。遺伝暗号発現とは、遺伝情報の生物学的機能への変換であると考えることができます。それゆ
え、蛋白質のフォールディングは、遺伝暗号発現の最終段階に対応します。また、細胞内小器官などのより高次の構造形成を行うためには、蛋白質分子が正しく
フォールディングすることが必要不可欠です。したがって、蛋白質のフォールディングは、生命現象に見られる自己組織化のもっとも要素化されたものとみなす
ことができます。これまでの研究から、蛋白質の立体構造を決めるための情報は、蛋白質を構成するアミノ酸配列に含まれていることが知られています。また、
蛋白質の天然状態は、生理的条件下における系の自由エネルギー極小の状態に対応すると考えられています。したがって、蛋白質のフォールディングは、物理化
学的な過程であり、熱・統計力学によって記述することができます。わたしたちは、生命現象を物理学の対象として捉え、生命科学と物質科学との境界に位置す
る蛋白質フォールディングの機構を解明することが、生命現象を理解するための鍵になると考えて研究を進めています。
100
アミノ酸残基程度からなる蛋白質の多くは、フォールディング反応の律速段階以前に、コンパクトで、天然状態に匹敵するほどの二次構造含量をもつ中間体を形
成します。フォールディング過程における中間体の蓄積は、蛋白質分子が効率的に天然状態に至るために必要であると考えられています。わたしたちは、実験的
な研究手法を用いてフォールディング反応過程において蓄積するこれら中間体を構造の面と、安定性の面の両面から特徴付けることによって、蛋白質のフォール
ディング機構を明らかにすることを目標としています。具体的には、さまざまな分光学的手法と高速反応測定法と組み合わせることによって、ほどけた状態から
天然状態へ至るフォールディングの反応速度論をモデルを用いて解析します。さらに、蛋白質工学的手法を用いて蛋白質分子のアミノ酸残基を置換することに
よって、アミノ酸残基レベルでの中間体の描像を見出すことを目指します。
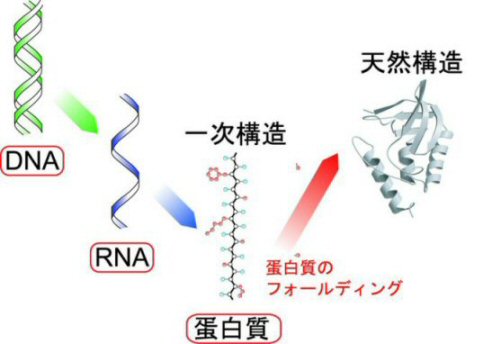
転写(DNAからRNAへ)・翻訳(RNAからアミノ酸配列へ)と
フォールディング(アミノ酸配列から機能を持つ構造へ)
分子レベルでの研究2−藍色細菌の生物時計の分子機構の研究
生物が内在的にもつ時間制御機構を生物時計と言います。生物時計を持つ生き物の中でも藍色細菌は最も単純な生物の一つです。藍色細菌の生物時計の特徴の
ひとつは、この生物の時計は、生体内において遺伝子発現に概日リズム-約24時間を周期とする周期的なふるまい-を示すだけでなく、試験管内においても、
時計蛋白質とよばれる一連の蛋白質KaiA,KaiBおよびKaiCが、ATP存在下で概日リズムを示すことです。概日リズムが認められる現象として、例えばKaiCの
リン酸化・脱リン酸化やATP加水分解反応といった化学反応、時計蛋白質たちの離合集散や時計蛋白質分子のかたちの変化といった時計蛋白質たちそのものの
ふるまいなどがあげられます。さらに時計蛋白質自体、もちろん生体内における概日リズム発振に不可欠なものです。私たちは,従来の生化学的研究に加えて,
分光学的手法などを取り入れることによって、概日リズムのしくみを物理学の視点から調べています。蛋白質のフォールディングがポリペプチド鎖内における
相互作用に焦点を当てるのに対して,時計蛋白質の概日反応は、蛋白質複合体形成と解離、つまり蛋白質間の相互作用に焦点を当てています。さらに、時計
蛋白質複合体形成に際して、時計蛋白質自体の構造が変化することもわかっています。蛋白質がもつ物理学的な側面に着目して、生命現象のしくみを捉えること
を目標にしています。
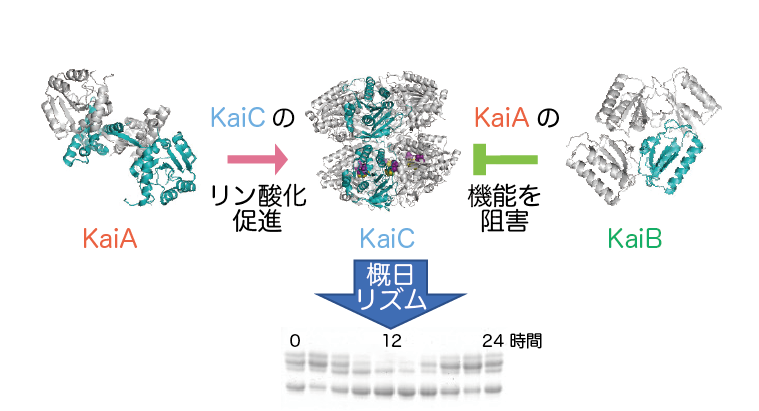
時計蛋白質KaiA、KaiBとKaiCの
はたらきとリン酸化状態で見た概日リズム
細胞レベルでの研究
― シナプス前神経末端の情報伝達機構とその可塑性のメカニズム
シナプスは神経細胞同士あるいは神経と他の細胞(感覚細胞や筋肉細胞)との接続部にある構造です。化学シナプス(下図参照)においては、この接続部にシ
ナプス間隙と呼ばれる30nm程度の隙間が空いているために、電気的信号がシナプス前末端からシナプス後細胞に直接伝わることはありません。化学シナプス
では、電気的信号をいったん化学的信号に変換し、再度電気的信号に戻すというメカニズムで情報を伝達しています。
神経軸索を伝播してきたパルス状の活動電位(デジタル的信号)は、シナプス前神経末端の細胞膜を脱分極させることで、そこに存在する電位依存性カルシウム
チャネルを開けます。細胞の内外には4桁にもなるカルシウムイオン濃度差があるので、開いたカルシウムチャネルから流入するカルシウムイオンによりカルシ
ウムチャ
ネル近傍に局所的高濃度カルシウムイオン領域が生じます。これがトリガーとなってカルシウムチャネルの近くにdockされていたシナプス小胞が細胞膜と膜
融合し、小
胞内に蓄積されている神経伝達物質がシナプス間隙に放出されます(開口放出)。神経伝達物質はシナプス後細胞膜に存在するレセプターチャネルに結合して陽
イオンチャネルを開き(興奮性シナプスの場合)、ナトリウムイオンが流れて後細胞側にシナプス後電位(アナログ的信号)を引き起こします。また、細胞内に
流入
するカルシウムイオンは、シナプス伝達効率の可塑性に対しても重要な役割を担っています。中枢等の神経系はシナプスを介してデジタル的活動電位をアナログ
的シナプ
ス後電位に変換することで情報の統合を可能にし、シナプス可塑性により記憶・学習等の高次機能を実現しています。
わたしたちは、カエルの神経筋接合部シナプスを用いて、シナプス小胞開口放出のメカニズムそのものや、刺激依存的に引き起こされるシナプス前由来の伝達
物質放出増大の短期可塑性や自発放出頻度増大の短期可塑性等の伝達物質放出量の調節メカニズムの解明を目指して研究しています。特にカルシウムイオン等の
二価陽イ
オンがこれらのメカニズムにどのように関与しているのかを、シナプス前末端内イオン動態イメージング法(イオンを結合すると明るさや色が変化する蛍光色素
を用いて、細胞内イオン濃度変化を可視化する方法、下図参照)や伝達物質放出量をモニターするための電気生理学的測定を通じて明らかにしてゆくことを目指
します。
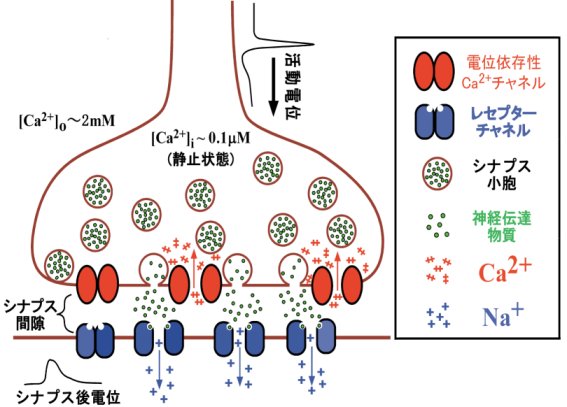
化学シナプスにおける情報伝達過程
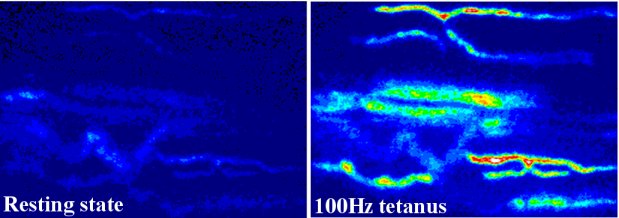
神経刺激時のシナプス前末端内のカルシウムイオン濃度変化の可視化